domingo, 4 de diciembre de 2016
ACT 6-16-17
ACTV 6-16-17 : REALIZACIÓN DE UN PÓSTER CIENTÍFICO DEL TRABAJO REALIZADO POR TODO EL EQUIPO

ACT 5-16-17
ACTV 5-16-17: ELABORACIÓN DE UN VIDEO DE LA PRÁCTICA LIBRE DE UN ENSAYO FÍSICO DEL MATERIAL A ESTUDIAR
lunes, 21 de noviembre de 2016
ACTV 13 -16-17: PRÁCTICA IDENTIFICACIÓN DE POLÍMEROS
ACTV 13: PRÁCTICA IDENTIFICACIÓN DE POLÍMEROS
Los resultados obtenidos tras la práctica son:
Para el plástico de color rojo podemos concluir que es polietileno debido a que presenta poco humo negro, una llama azul y naranja, se funde, flota y además su densidad es de 0,8879 g/mL.
Para el plástico de color azul podemos concluir que es polipropileno debido a que presenta humo negro, una llama naranja, gotea, flota y además su densidad es de 0,9005 g/mL.
Para el plástico de color amarillo podemos concluir que es poliestireno debido a que presenta mucho humo negro, una llama naranja, chisporrotea, no flota en agua pero si en agua con sal y además su densidad es de 1,005 g/mL.
Para el plástico de color verde podemos concluir que es polietileno debido a que presenta humo negro, una llama naranja, ablanda, no flota en agua pero si en agua con sal y además su densidad es de 1,1889 g/mL.
Para el plástico de color blanco podemos concluir que es polipropileno debido a que no presenta humo,no hay llama, no arde, flota y además su densidad es de 1,0006 g/mL.
TABLA DE COMBUSTIÓN
TABLA DE DENSIDAD
ACTIVIDAD 1
BOTELLA DE PLÁSTICO
PAPEL DE FILM
TAPÓN DE BOTELLA
BRIDA
ACTIVIDAD 2
FRASCO LAVADOR
TUBO DE CENTRÍFUGA
TAPÓN
GOMA DEL GAS
PARAFILM
ACTIV 12-16-17: CAMBIOS DE FASES Y DIAGRAMAS DE EQUILIBRIO
ACTIV 12-16-17: CAMBIOS DE FASES Y DIAGRAMAS DE EQUILIBRIO
DIAGRAMA DE FASES DEL AGUA

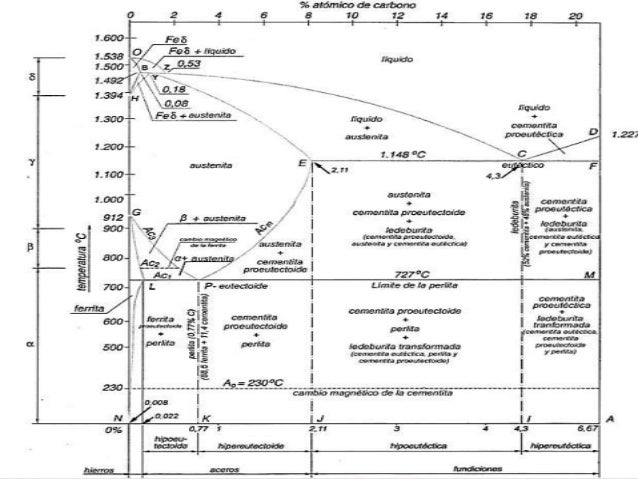
DIAGRAMA DE FASES HIERRO-CARBONO
COMO MEJORAR EXPERIMENTALMENTE EL DIAGRAMA DE CALENTAMIENTO DEL AGUA
Para mejorar la gráfica del calentamiento del agua una de las mejores opciones que podemos tomar es la toma de un mayor numero de puntos de temperatura. Para ello debemos calentar el agua progresivamente y a un ritmo más lento que el que hicimos en la práctica ya que así podríamos obtener un resultado más preciso debido a la obtención de un mayor número de puntos.
Además se puede mejorar con materiales de laboratorio que sean más precisos.
CONCLUSIÓN CIENTÍFICA
La conclusión científica a la que llegamos tras la realización del ensayo es que los resultados obtenidos los cuáles nos permiten realizar la gráfica de la curva del calentamiento del agua son muy similares a los datos que se pueden apreciar en la gráfica teórica.
Podemos observar en nuestra gráfica un momento de temperatura constante el cual nos permite identificar el cambio de fase del agua, primero del estado sólido a estado líquido y después el cambio de fase de estado líquido a estado gaseoso.
ACTV 11: FRAGUADO DEL YESO
ACTV 11: FRAGUADO DEL YESO
Lo primero que realizamos es la pesada del yeso en la cuál debemos obtener 50 gramos aproximadamente de yeso. Para ello añadimos el yeso en un reloj de vidrio o también podemos añadirlo en un vaso de precipitados.
Posteriormente debemos proceder a enfriar y calentar la temperatura del agua, para los distintos tipos de ensayo con las temperaturas de 10ºC, 23ºC, 30ºC, 40ºC y 50ºC. Y cuando alcancemos la temperatura correspondiente añadimos 25 mL del agua destilada a los 50 gramos de yeso.
También realizamos el mismo ensayo pero esta vez añadimos un aditivo, el cual será NaCl y siempre se realizará a una misma temperatura (temperatura ambiente). Los porcentajes de NaCl que debemos añadir a la mezcla son en 1%, 3%, 5% y 7% 50 g de yeso.
Removemos la mezcla durante 1 minuto para que ambos materiales, agua destilada y yeso, se mezclen creando una masa homogénea; en este momento es cuando comenzamos a contar el tiempo. Y a partir de este instante procedemos a hacer las 'galletas' de yeso. De cada una de las diferentes temperaturas o diferentes % de a aditivo debemos hacer 3 galletas lo mas similares posible entre sí. Siempre nos fiaremos en la medida de la segunda galleta. Debemos dividir las galletas a la mitad y cuando estas no se unan podemos decir que el yeso está fraguado
lunes, 31 de octubre de 2016
ACTV2-16-17: DETERMINACIÓN DE LA PUREZA DEL PAPEL DE ALUMINIO
DETERMINACIÓN DE LA PUREZA DEL PAPEL DE ALUMINIO
MATERIAL Y REACTIVOS
Material:
- Probeta 500 ml
- Cristalizador
- Goma
- Embudo de decantación
- Matraz kitasato
- Tapón
- Soporte
- Pinzas
Reactivos:
- HCl
- Agua destilada
- Papel de aluminio
FUNDAMENTO
La práctica realizada nos permite conocer la pureza del papel de aluminio comercial. Para ello necesitamos generar una reacción entre el papel de aluminio y otro compuesto, en nuestro caso el HCl. El volumen de H2 desprendido en la reacción, es recogido en agua, y esto nos permite averiguar cual es el porcentaje de pureza del papel de aluminio comercial
La reacción que se lleva a cabo entre el papel de aluminio y el HCl es la siguiente:
Al + 3 HCl → AlCl3 + 3/2 H2 (g)
CÁLCULOS PREVIOS
A partir de la ecuación de los gases ideales, calculamos la cantidad de aluminio puro que necesitamos emplear para obtener un volumen de 90 mL de hidrógeno gas en la probeta (recogido en agua). La ecuación de los gases ideales es :PxV=nxRxT
Conociendo:
V=90mL
P=1 atm
R=0.082 atm L/ K mol
T=23ºC=296.15K
1atm x 0,09L
n=-------------------------------------= 3.71*10^-3 mol H2
0.082(atm*L/K*mol) x 296.15K
1 mol Al 26.98g Al
3.71*10^-3 mol H2 x -------------------- x ----------------------- = 0.066 g Al
3/2 mol H2 1 mol Al
PROCEDIMIENTO EXPERIMENTAL
Para la realización de la práctica de determinación de la pureza del papel de aluminio debemos comenzar por tomar las muestras de aluminio necesarias para desalojar un volumen de 90 mL. Para ello debemos realizar unos cálculos previos para conocer los gramos de aluminio que tomaremos.
Posteriormente realizamos la disolución de HCl correspondiente para hacer reaccionar el papel de aluminio con éste, y generar el H2 que nos permitirá conocer la pureza del papel de aluminio.
Ahora realizamos el montaje de la práctica, para ellos debemos llenar una probeta con agua, en nuestro caso la probeta era de 500 mL. Debemos introducirla en un cristalizador, el cual debe contener agua previamente. introducimos la probeta en el cristalizador evitando la formación de burbujas de aire ya que pueden variar los datos sobre el volumen de H2 recogido (imagen).
Tras colocar la probeta procedemos a insertar una goma en el matraz kitasato y por el otro lado dentro de la probeta que se encuentra en el cristalizador. ahora ya tenemos realizado el montaje.
Procedemos a realizar la práctica, y para ello tenemos dos métodos: uno mediante goteo (imagen a), ayudándonos de un embudo de decantación, y otro añadiendo todo el ácido a la muestra de aluminio (imagen b).
(a)
(b)
Añadimos el papel de aluminio al matraz kitasato y agregamos el ácido, los 2 primeros ensayos son mediante goteo y los 4 siguientes son realizados añadiendo todo el ácido. Debemos sellar rápidamente con el tapón para no perder gas, y así obtener un volumen más acertado.
La pureza del aluminio es calculada a partir del volumen de H2 que desprende la reacción y que desplaza el volumen de agua que contiene la probeta (imagen).
RESULTADOS
Los resultados obtenidos se presentan en la siguiente tabla:
CONCLUSIÓN CIENTÍFICA
La conclusión que se obtiene tras la realización de los 6 ensayos es que la pureza del papel de aluminio comercial, del cuál se realizaron los experimentos, es aproximadamente del 100% ya que a pesar de que los datos obtenidos superan ese porcentaje se puede interpretar que el aluminio es altamente puro.
domingo, 23 de octubre de 2016
PRÁCTICA : Acción de los ácidos sobre los metales
FUNDAMENTO:
Las reacciones de desplazamiento o de sustitución son reacciones en el cual átomos de un elemento reemplazan a átomos de otro elemento en un compuesto, todas las reacciones de desplazamiento simple son reacciones denominadas redox, los elementos que están en un estado de oxidación cero se hacen iones.
Estas reacciones se pueden agrupar en tres tipos, de los cuales nos centraremos en los que emplearemos en nuestras prácticas; en las que al tratar un metal con un ácido se produce una sal y se desprende hidrógeno.
Ácido + Metal ------> Sal + H2
En la siguiente práctica comprobaremos las diferentes reacciones que se producen con los siguientes elementos:Los metales que emplearemos son cobre (Cu), aluminio (Al), hierro (Fe) y zinc (Zn)Los ácidos que utilizaremos en esta práctica son ácido clorhídrico (HCl), ácido sulfúrico (H2SO4), ácido nítrico 2 M y ácido nítrico concentrado (HNO3)
HCl + Al
HCl + Cu
HCl +Fe
HCl +Zn
H2SO4 + Al
H2SO4 + Cu
H2SO4 + Fe
H2SO4 + Zn
H2SO4 + Moneda cobre
MEDIDAS DE SEGURIDAD
Para las medidas de seguridad en esta práctica fue necesario el uso de EPIs y también de campana para las reacciones que desprendían gas, ya que suponían un cierto peligro.
CONCLUSIÓN CIENTÍFICA
La conclusión que se obtiene de esta práctica es que en las reacciones que se produjeron, se pueden presenciar reacciones exotérmicas, en algunas de ellas se producían cambios de color, también burbujas en todas las que reaccionaban debido al desprendimiento de hidrógeno gas (H2)
En otras reacciones como las del nítrico concentrado se forma una capa que protege al metal, esto ocurre en los materiales como el Al. Esta formación es conocida como pasivación.
Suscribirse a:
Entradas (Atom)














































